Los electrolizadores de agua generalmente se clasifican según la temperatura: alta temperatura y baja temperatura; y a su vez los electrolizadores de baja temperatura se clasifican según el pH del medio de operación: electrolizadores alcalinos (EA) y electrolizadores ácidos de membrana de intercambio de protones (PEM). A nivel comercial, ya se pueden encontrar electrolizadores PEM y EA, siendo este último el más ampliamente utilizado por la industria debido a sus capacidades de producción. De hecho, los EA comerciales son capaces de generar hasta 750 Nm³/h de Hidrógeno, mientras que los electrolizadores comerciales PEM pueden generar hasta 30 Nm³/h de H2.
La implementación de ambos electrolizadores a gran escala comercial e industrial requiere de mejoras científicas y tecnológicas que permitan aumentar las densidades de potencia de los stacks, simplificar la complejidad del sistema, mejorar la estabilidad de sus componentes a largo plazo debido, y disminuir el alto costo asociado al coste de los catalizadores (normalmente de materiales críticos o escasos) y de las membranas.
Los electrolizadores alcalinos por sus mayores prestaciones, su mayor durabilidad y su mejor relación productividad precio, son actualmente más atractivos para aplicaciones industriales. Sin embargo, uno de los principales problemas de los electrolizadores alcalinos es su gran tamaño, pero, avances recientes, han logrado disminuir su volumen total asumiendo una configuración de “zero-gap (cuando el espacio entre membrana y electrodos es cero)”.
No obstante, esta configuración no viene libre de retos ya que tiene problemas de conductividad y problemas asociados a la acumulación de burbujas del Hidrógeno y Oxígeno formado en la superficie del electrodo. Como resultado de estos inconvenientes técnicos, la densidad de potencia de los electrolizadores alcalinos se ve afectada.
La eficiencia de los electrolizadores convencionales actuales, y por tanto la velocidad de producción de H2, también se encuentra condicionada por la velocidad de formación de oxígeno, que es una reacción compleja, lenta y la causante de la degradación de los catalizadores a largo plazo.
Además, uno de los retos más relevantes en ambos electrolizadores, tanto los EA como de los PEM, es la difusión de gases a través de las membranas. Dicha difusión de los gases, si no es controlada, puede resultar en mezclas explosivas de H2 y O2. Y aunque el diseño de las membranas ha avanzado significativamente en los últimos años aumentando su conductividad iónica y disminuyendo su permeabilidad de gases, las membranas actuales no son completamente impermeables a los gases y, en particular, a la permeación del hidrógeno. Esto supone un reto para la seguridad del sistema, y por esta razón, las presiones de H2 y O2 generadas deben ser controladas muy cuidadosamente para evitar que permeen entre los compartimientos anódicos y catódicos.
Mantener los gases separados en ambos compartimientos, no es trivial. Cuando un electrolizador se encuentra conectado a fuentes renovables de energía como la eólica o la solar, la potencia de entrada es variable y, por lo tanto, la velocidad de generación, y las presiones del H2 y O2 también son variables. Asimismo, cuando las densidades de corriente son bajas, la producción de H2 también es lenta y muy similar a la velocidad de permeación del gas a través de la membrana. Por ejemplo, un electrolizador conectado a placas solares con una eficiencia de 10% de transformación de energía sol-combustible y bajo la exposición solar de 100 mW cm–2 operaría a una densidad de corriente, de 10 mA cm–2, que es considerado un buen punto de referencia. Sin embargo, en estas densidades de corriente, la permeación de hidrógeno puede ser potencialmente peligrosa ya que el límite potencial de explosión en mezclas de hidrógeno y oxígeno son de tan solo el 4%.
Una tecnología rápida y económica que nos permite solucionar estos problemas son las celdas desacopladas. En los electrolizadores desacoplados, la evolución de H2 ocurre simultáneamente con la oxidación de un mediador intermediario, que posteriormente se reducirá con la formación de oxígeno (Figura 1). Por tanto, en los electrolizadores desacoplados la formación de H2 y O2 están separadas en tiempo y espacio, evitando así la mezcla de gases cuando el dispositivo está conectado a fuentes de energía renovables.
Además, ya que la producción de H2 y O2 no ocurre simultáneamente, tampoco existe la necesidad de pasos adicionales, generalmente costosos, para la purificación de H2.
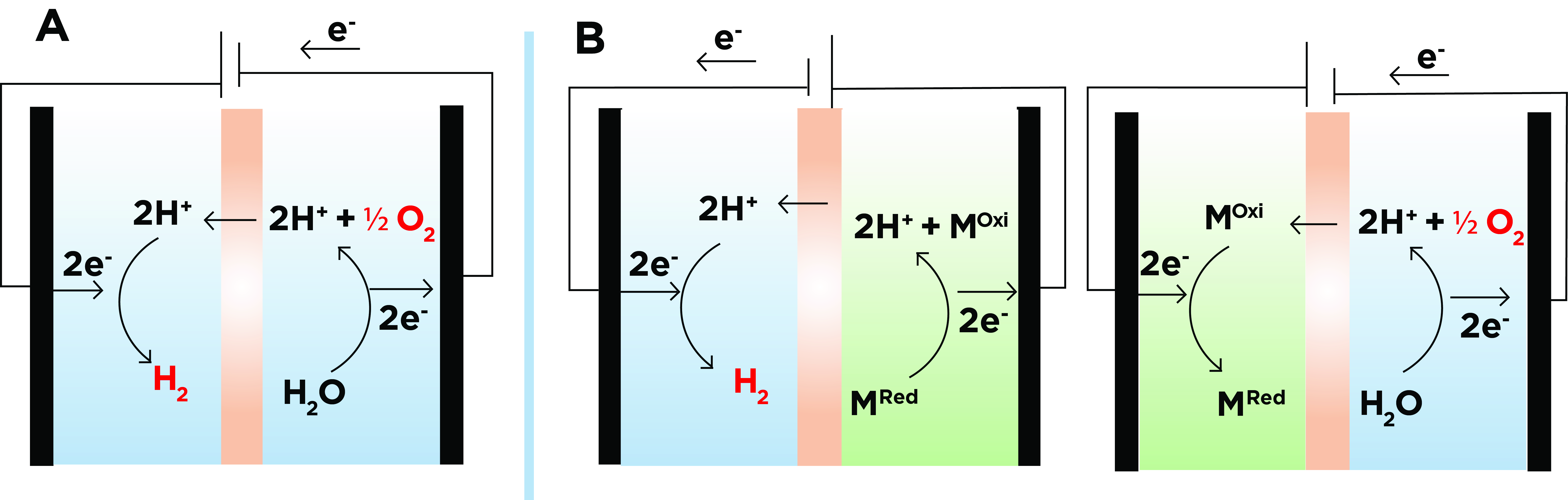
Figura 1: Diagramas representativos de un electrolizador de agua convencional simplificado (A) y un electrolizador de agua desacoplado en medio líquido (B). En la figura B a la derecha, la evolución de O2 se encuentra acoplada a la reducción del mediador redox (MOxi+2e-+2H+-> MRed) y a la izquierda la evolución de H2 se encuentra acoplada a la oxidación del mediador redox (MRed -> MOxi+2e-+2H+).
La eficiencia de la producción de H2 también mejora en las celdas desacopladas, ya que la velocidad de producción de hidrógeno, depende únicamente de la velocidad de oxidación del mediador redox (usualmente rápida) y es independientemente de la velocidad de formación de oxígeno. Cierto es que la selección del mediador redox ha de ser óptima y su velocidad de oxidación comparable a la velocidad de generación de H2 en el medio electrolítico deseado, ya sea ácido o alcalino.
Adicionalmente, como la producción de H2 y O2 no están acopladas en tiempo y espacio, la evolución de O2 puede ser sustituida por la oxidación de otras especies adaptadas a las necesidades de la empresa, como por ejemplo síntesis de H2O2 (agua oxigenada), Cl2 (cloro) u oxidación de residuos orgánicos de la propia empresa. Lo que supone una mayor adaptabilidad del sistema y una reducción de costos de producción de H2.
Cuando se habla de mediadores redox para celdas desacopladas, estos se puedenn agrupar en mediadores redox en medio fluido, bien sea acuoso u orgánico, y en mediadores redox sólidos. Independientemente de su estado físico, fluido o sólido, los dos requerimientos principales de dicho mediador han de ser que: i) el mediador sea estable en su forma oxidada o reducida, y ii) que los potenciales de oxidación y reducción se encuentren dentro de la ventana de potencial de evolución de hidrógeno y oxígeno.
Las primeras investigaciones de celdas desacopladas con mediadores redox en medio líquido se insipiraron en las celdas de redox de flujo en medio acuoso, empleando pares redox de iones metálicos como el Vanadio y el Cerio en disolución. No obstante, muchas de estas especies son poco solubles en agua, o sufren de escasa estabilidad a largo plazo en condiciones reales de pH y operación. De manera alternativa, algunas moléculas orgánicas portadoras de carga ofrecen ciertas ventajas como mediadores redox. Los mediadores redox orgánicos presentan una mayor flexibilidad en comparación con los de iones metálicos, ya que un mediador redox orgánico puede funcionalizarse para aumentar su solubilidad y, a su vez, puede ser portadora de varias cargas. Como resultado, la densidad de potencia puede aumentarse en gran medida, mejorando las prestaciones finales del electrolizador.
Por otra parte, cuando se implementan mediadores redox sólidos en las celdas desacopladas, la oxidación y reducción del mediador ocurre en la superficie de un electrodo sin pasar a la fase acuosa. La principal ventaja de la utilización de mediadores redox sólidos es la disminución del volumen y la complejidad del electrolizador ya que no requiere de grandes volúmenes de líquido recirculando con el mediador. Adicionalmente, los electrolizadores desacoplados con mediadores redox sólidos ofrecen un menor coste de operación y mantenimiento, ya que no requieren de dos electrodos para la oxidación y reducción de las especies en disolución y, al mismo tiempo, tampoco requieren de membranas. Estudios recientes han demostrado la viabilidad y ventajas de los electrolizadores desacoplados con electrodos de óxidos de níquel como mediador redox, sin embargo, otros electrodos sólidos basados en óxidos metálicos multivalentes y estables tienen el potencial de mejorar significativamente las prestaciones de los electrolizadores desacoplados con mediadores sólidos.
Como conclusión, el desarrollo e implementación de electrolizadores de agua desacoplados viene a proporcionar soluciones reales a las limitaciones actuales de los electrolizadores convencionales como la densidad de potencia del stack y la mezcla de gases explosivos. Desde su aparición, y en menos de 5 años, ha logrado evolucionar en distintos aspectos destacando por su versatilidad y seguridad. Sin embargo, debe enfocarse en mayor énfasis en estudios a nivel fundamental para el desarrollo de materiales redox, tanto fluidos como sólidos, y en las mejoras en el diseño de la celda. Los electrolizadores desacoplados tienen un gran potencial para sustituir los electrolizadores convencionales, alcalinos y PEM, y aprovechar eficientemente las fuentes de energía renovable intermitentes para la generación y almacenamiento de H2.

Autor: Paramaconi Rodríguez Pérez, Ikerbasque Research Professor y Jefe de grupo de Investigación Tecnologías electroquímicas del hidrógeno de CIC energiGUNE.

Si quieres conocer las últimas tendencias en almacenamiento de energía y novedades en investigación, suscríbete.

Si quieres unirte a un equipo de primer nivel, colaborar con especialistas en múltiples disciplinas o contarnos tus inquietudes no te lo pienses…