Entre los puntos esenciales a discernir, los siguientes son los primeros pasos hacia la comprensión y el posterior control de los ánodos de Li metal:
- ¿Cuál es la naturaleza de la superficie del ánodo de Li metal?
Se supone que la superficie de las láminas de litio utilizadas como ánodos está realmente formada por litio. Sin embargo, siendo el litio un elemento altamente reactivo y siendo la superficie de cualquier sistema la interfaz entre la masa y el resto del universo, es más que plausible pensar que la superficie de las láminas de litio consistirá en algo más que el litio.
Nuestras observaciones han llegado a la conclusión de que incluso si el litio se mantiene bajo una atmósfera inerte en una caja de guantes llena de Ar, las trazas de agua, oxígeno, etc., presentes en las líneas de procesamiento de litio o en los lugares de almacenamiento, son suficientes para generar una gruesa capa de carbonato de litio que cubre la lámina de Li. En otras palabras, el Li metal utilizado para ensamblar una celda está cubierto por una capa de Li2CO3 de una micra de espesor que será la interfaz con el electrolito.
- ¿Es posible obtener un ánodo de Li metal puro?
Como se ha confirmado en el punto anterior, en una batería con ánodo metálico de Li, el Li2CO3 es el material que está en estrecho contacto con el electrolito. Por lo tanto, nos interesaba obtener el metal puro de Li para comprender el comportamiento de este material puro, primero, durante su manipulación para el montaje de la batería y, segundo, en contacto con el electrolito durante el ciclado electroquímico.
Por esta razón, desarrollamos un procedimiento de limpieza que nos permitió obtener superficies de litio metálico con una pureza >95%. Este método se basa en el grabado de la superficie de litio mediante un haz de iones inertes hasta que se elimina la capa de carbonato de litio exponiendo el metal puro.
- ¿Cómo interactuará el Li metal con los gases presentes en las líneas de procesamiento de la batería?
Las instalaciones actuales para el ensamblaje de baterías de Li-ion dependen de tener los pasos sensibles a la humedad encerrados en un ambiente de atmósfera seca. En otras palabras, si consideramos el metal puro de Li que se procesa en este ambiente, la superficie de Li estaría principalmente expuesta al oxígeno (O2), nitrógeno (N2) y dióxido de carbono (CO2). Por lo tanto, expusimos nuestras superficies de Li puro a dosis controladas de O2, N2 y CO2 puro.
Como era de esperar, la exposición al oxígeno conduce a la oxidación de la superficie de Li con la subsiguiente formación de óxido de litio (Li2O). La exposición al dióxido de carbono dio como resultado la formación de una capa superpuesta compuesta de Li2O y Li2CO3. La formación de estos compuestos resulta de la disociación de las moléculas de gas inducida por el carácter altamente reductor del Li puro. Sin embargo, este gradiente de energía no es suficiente para disociar las moléculas de N2 que no reaccionan bajo ninguna circunstancia con la superficie de Li.
- ¿Cuál es el efecto de esa interacción?
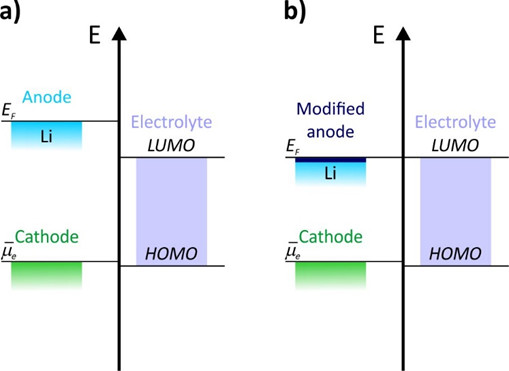
Lo ideal sería que la modificación de la superficie de Li ayudara a estabilizar la interfaz ánodo-electrolito. Esto sólo ocurrirá si la energía del electrodo, que en primer término aproximamos a la energía de Fermi, cae dentro de la ventana de estabilidad del electrolito, que es la zona gris de la figura adjunta. Puede definirse como la región de energía que asegura la estabilidad de la interfaz de contacto.
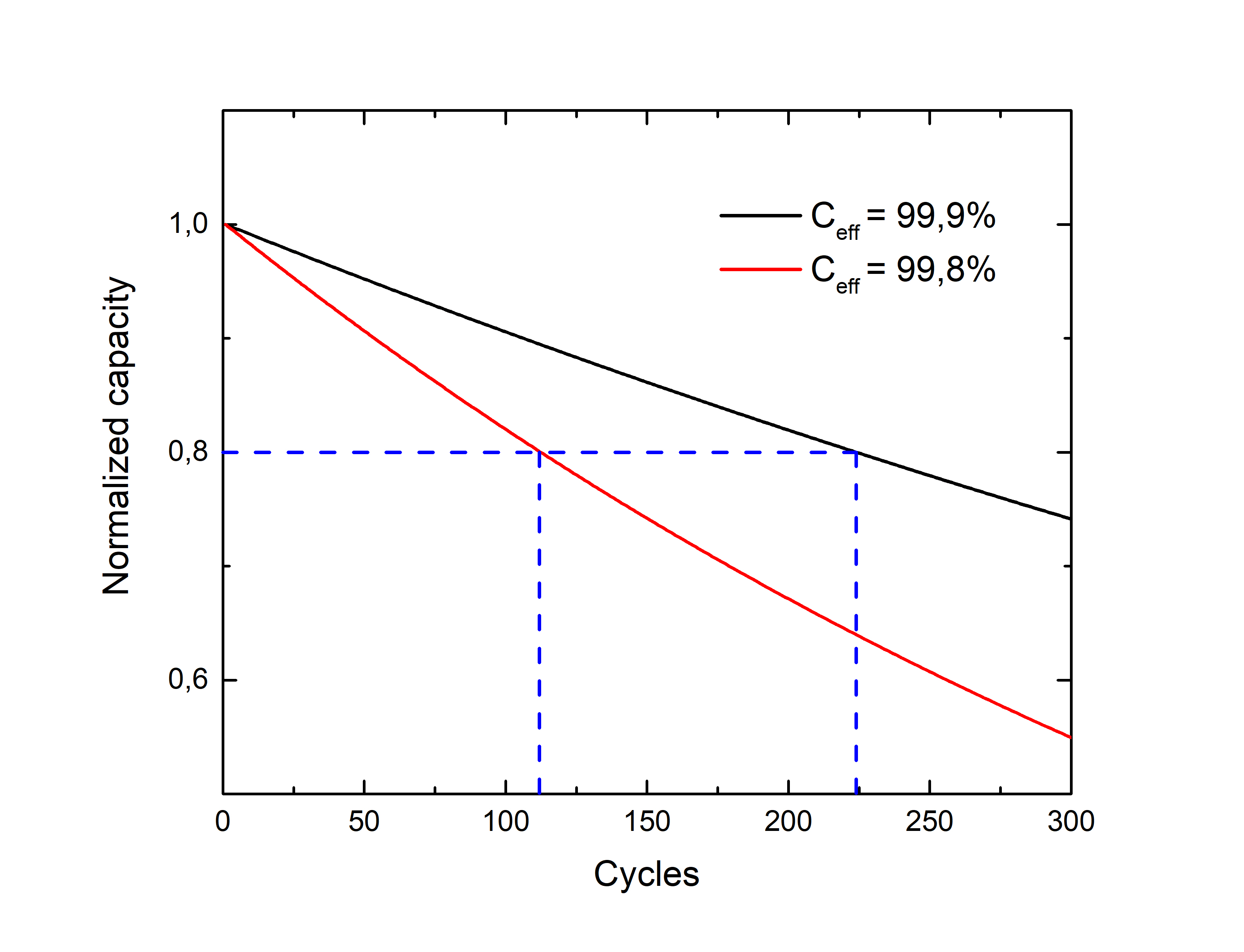
Una interfaz de contacto fuera de esta ventana dará lugar a una reducción u oxidación espontánea del electrolito y, en última instancia, a la degradación de la celda. Por ejemplo, una disminución del 0,1% en la eficiencia coulombica, que es la relación entre la capacidad de carga y descarga, del 99,9% al 99,8%, implica una disminución del 50% en la vida útil de la celda (definida esta última como el número de ciclos antes de alcanzar el 80% de la capacidad inicial).