¿Por qué cambiar las baterías de iones de litio?
Tradicionalmente, las baterías de iones de litio han sido el caballo de batalla del almacenamiento de energía, satisfaciendo las prometedoras demandas energéticas de la sociedad. Desgraciadamente, no pueden alcanzar la escala de mejora transformadora necesaria debido a: (i) el limitado suministro geográfico de litio (con el consiguiente aumento del coste), (ii) la escasez de cobalto y (iii) la limitada capacidad de almacenamiento de energía.
Su adopción generalizada se enfrenta a importantes obstáculos, lo que merma su potencial de implantación a gran escala. Aquí entra el atractivo de las baterías de sodio-aire/O2.
Desvelando el potencial de las baterías de Na-aire/O2
Las baterías de Na-aire/O2 ofrecen un cambio de paradigma en la dinámica del almacenamiento de energía. Las baterías de Na-aire/O2 abordan directamente los problemas señalados anteriormente debido a: (i) la gran abundancia de sodio (Na) y su bajo coste (~30 veces más barato que sus homólogas de litio), (ii) la ausencia de necesidad de cobalto, y (iii) su alta densidad energética teórica como resultado del uso de un cátodo de aire ligero.
Las baterías de Na-aire/O2 presentan ca. 5-10 veces superior a la de las baterías de Li-ion y Na-ion (1.605/1.108 frente a 100-265 y ~150 Wh kg-1, respectivamente), ya que el material activo se toma del entorno (O2).
Principios de funcionamiento y mecanismos de las baterías de Na-aire/O2
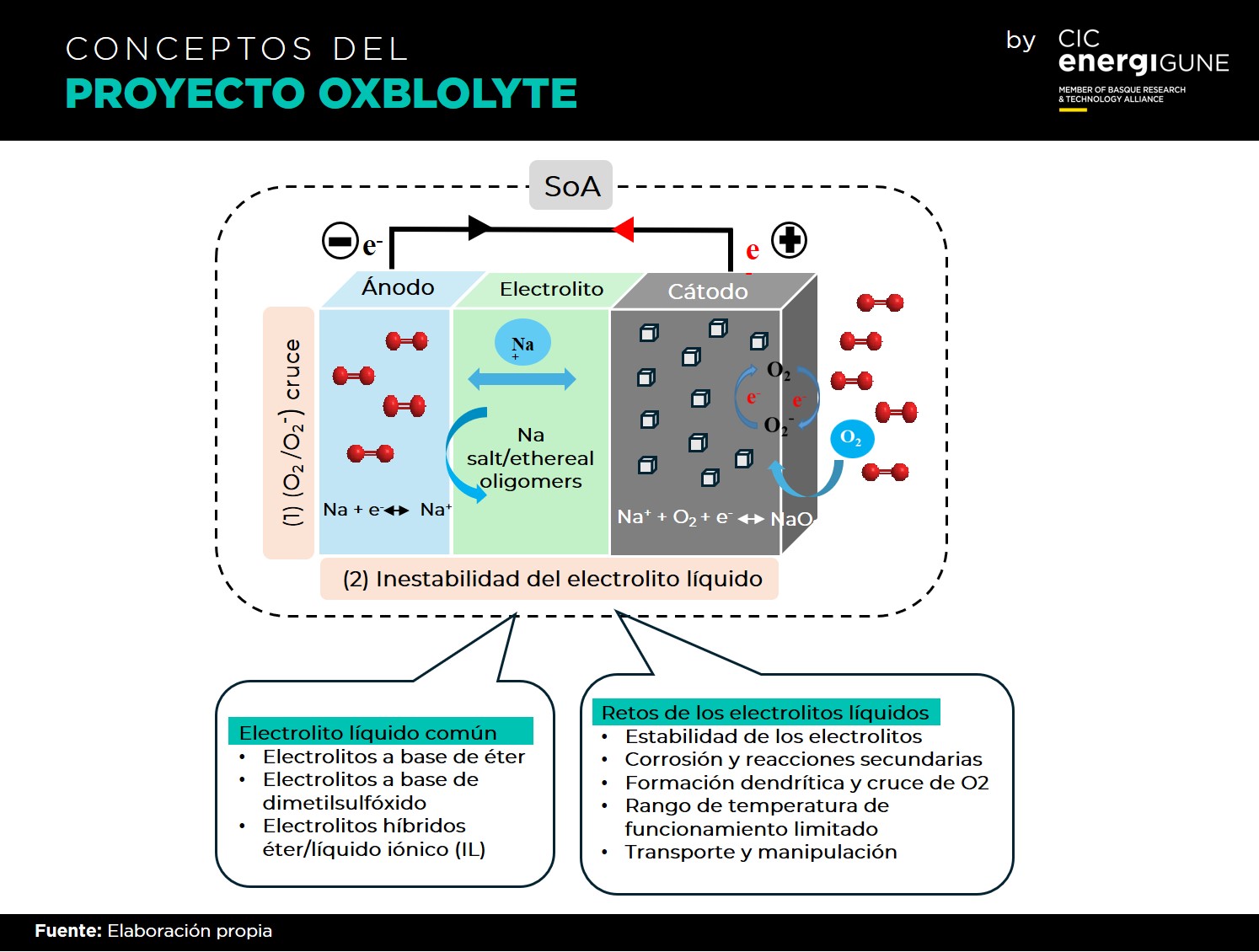
Una batería de Na-aire/O2 consta de tres elementos clave: un ánodo de sodio metálico, un cátodo de aire poroso y un electrolito que actúa como separador entre ambos. El funcionamiento de las baterías de Na-O2 basadas en superóxidos sigue principalmente las ecuaciones (I) y (II):
Na+ + O2 + e- ↔ NaO2 (Eº = 2,27 V) (I)
2Na+ + O2 + 2e- ↔ Na2O2 (Eº = 2,33 V) (II)
El inicio de la reacción de reducción de oxígeno (ORR) implica típicamente un proceso de reducción de un electrón, dando lugar a aniones superóxido (O2-) que reaccionan con cationes de metal de sodio (Na+) de la reacción de oxidación del ánodo para formar el producto de descarga (NaO2). Durante la descarga, el ánodo metálico de sodio se oxida, liberando iones Na+, mientras que el cátodo facilita la ORR utilizando el oxígeno disponible en los límites de la triple fase (electrodo de aire/O2/electrolito).
Se proponen dos mecanismos principales, el mediado por la solución y el mediado por la superficie, para la formación del producto de descarga NaO2. Además, se reconoce ampliamente que la selección del electrolito es fundamental, ya que la forma, el tamaño y el mecanismo de formación del producto de descarga de NaO2 dependen en gran medida de las propiedades fisicoquímicas del electrolito.
Afrontar los retos con decisión
Los retos a los que se enfrentan las baterías de Na-aire/O2 son notables, pero no imposibles. Se han identificado problemas como la inestabilidad del electrolito líquido, el cruce O2/O2-, la pasivación del ánodo de sodio y el crecimiento dendrítico, y se están abordando activamente. Estrategias como la exploración de electrolitos en estado sólido (SSE), la mitigación del cruce O2/O2-, la protección del ánodo de Na y la mejora de la interfase electrolítica sólida (SEI) se están estudiando como posibles soluciones.