Se trata de una pregunta que no es fácil de responder. En palabras del Prof. Tom Welton del Imperial College de Londres, “…un líquido iónico es una sal que no genera un buen sólido”. En general, un Líquido Iónico-literalmente “sal líquida”-puede definirse como una sal que se derrite(se convierte en líquido) antes de descomponerse.
Los líquidos iónicos se component habitualmente de cationes y aniones orgánicos e inorgánicos. Existe un extensivo, pero controvertido consenso sobre la clasificación de estos materiales iónicos en dos grupos: los llamados “ Líquidos iónicos a temperatura ambiente” que son aquellas sales que se vuelven líquidas a temperaturas inferiores o iguales a los 100ºC, y las llamadas “sales fundidas” que se derriten a temperaturas mucho más altas (por ejemplo, NaCl a los 803ºC). Esta controvertida clasificación de los líquidos iónicos esta basada de manera arbitraria en las temperaturas de fusión, pero también se puede distinguir entre tipos según diferencias evidentes en la aplicabilidad práctica de ambos.
En este artículo, nos centraremos en los llamados “líquidos iónicos a temperatura ambiente”, sus propiedades únicas y sus ámbitos de aplicación.
El descubrimiento del primer compuesto considerado un líquido iónico puede atribuirse a Paul Walden, en 1914, cuando estaba buscando sales fundidas que pudieran presentarse en estado líquido a la temperatura a la que trabajaba su equipo. Este primer líquido iónico era el nitrato de etilamonio ([EtNH3][NO3]), con una temperatura de fusión de 12ºC y considerado el primer líquido iónico en ser mencionado en la literatura científica.
Después, la investigación y los avances en el potencial de los líquidos iónicos pasó desapercibido durante un tiempo. No fue hasta los años 60 del pasado siglo cuando la investigación de los líquidos iónicos fue promovido gracias a un proyecto de investigación inicial de la Academia de las Fuerzas Armadas de EEUU, liderado por el comandante (Dr.) Lowell A. King. El principal objetivo entonces era descubrir un sustituto de los electrolitos de las sales fundidas del LiCl/KCl utilizados en baterías térmicas. Desde entonces, la Academia de las Fuerzas Armadas estadonidense apostó por un programa continuo para la investigación de estos líquidos iónicos, donde desarrollaron varios líquidos iónicos combiando diferentes cationes y aniones durante casi cuatro décadas.
Algunos de los líquidos iónicos más relevantes descubiertos durante las décadas comprendidas entre los 60 y los 90 se muestran en la siguiente tabla:
|
Líquido Iónico |
Año (ref.) |
|
|
[Et3NH][CuCl2] |
1963 (Inorg. Chem.,1963, 2, 1210) |
|
|
[N2222][GeCl3] and [N2222][SnCl2] |
1972 (J. Am. Chem. Soc., 1972, 94, 8716) |
|
|
[RPy][AlCl4] and [R2Im][AlCl4], R=alkyl] |
1982 (Inorg. Chem. 1982, 21, 1263) |
|
|
[R2Im][BF4] and [R2Im][PF6] |
1992 (Chem. Commun., 1992, 965) |
|
|
[R2Im][NTf2] |
1996 (Inorg. Chem. 1996,35,1168) |
|
|
Im = imidazolium, Py = pyridinium, NTF2 = bis(trifluoromethylsulfonyl)amide, N2222 = tetraethylammonium, EtPyBr = n-ethyl pyridinium bromide and Et3NH = triethyl ammonium. |
||
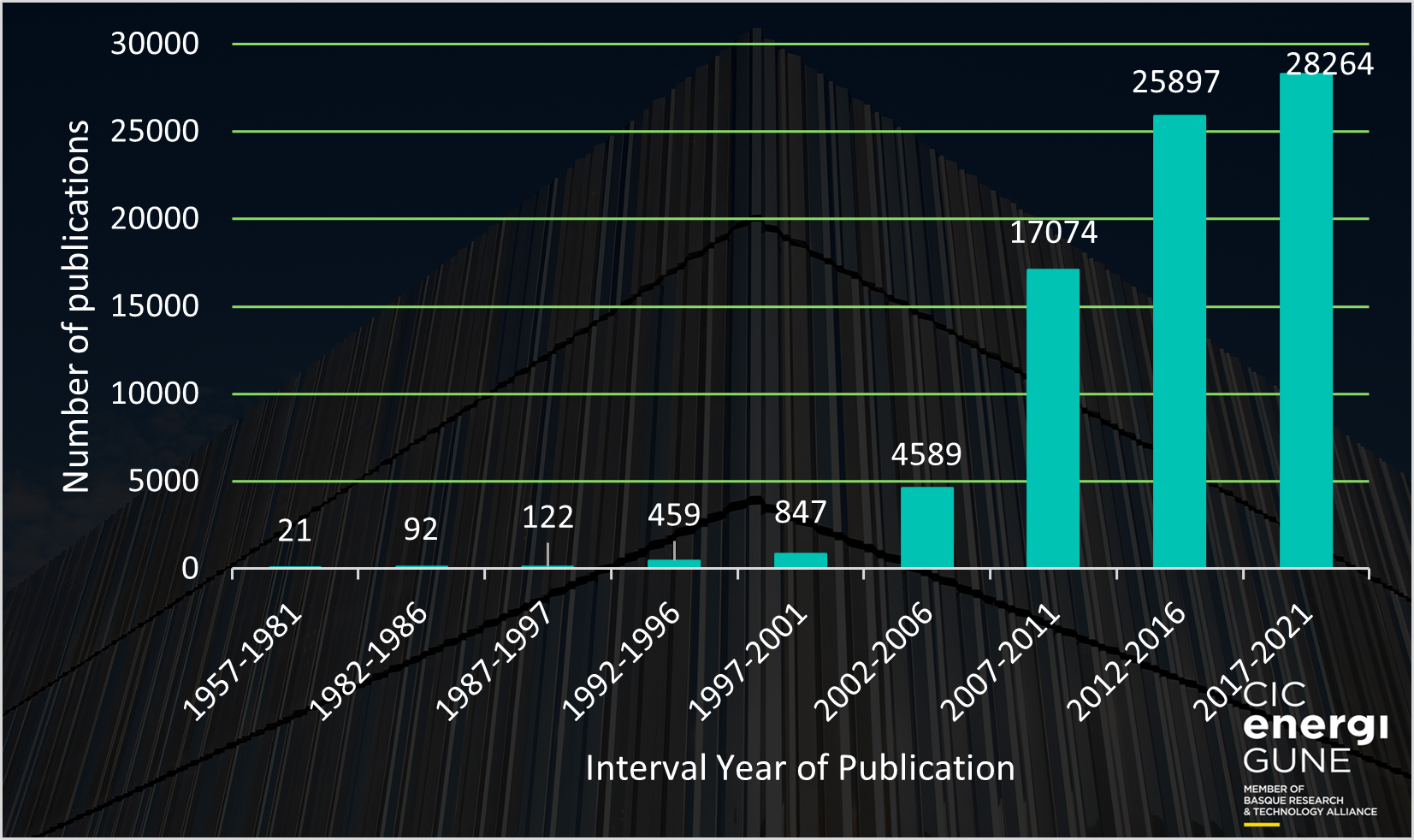
Más tarde, a principios del siglo XXI, el interés en los líquidos iónicos y sus potenciales aplicaciones experimentaron un renacimiento y empezaron a captar el interés entre la comunidad científica. Este interés se vio claramente reflejado en el número de publicaciones científicas donde el “líquido iónico” aparecía como alguna de las palabras clave. Echando un vistazo al siguiente gráfico, uno puede deducir que en los últimos 10 años (2012-2021), el interés de la comunidad científica en los líquidos iónicos (>54.000 publicaciones científicas) creció enormemente, y la tendencia es a que siga creciendo en los próximos años (ya son más de 3.000 publicaciones en lo que va de 2022).
Los líquidos iónicos poseen propiedades únicas que las hacen especiales para aplicaciones específicas. De hecho, sería potencialmente posible diseñar y sintetizar el líquido iónico con las cualidades requeridas para casi cualquier aplicación debido a sus ilimitadas combinaciones posibles entre cationes y aniones.
Entre las propiedades únicas que la mayoría de líquidos iónicos poseen, caben destacar las siguientes:
En general, los líquidos iónicos poseen las propiedades típicas de un sólido, pese a estar presentes en estado líquido. Además de estas características, los líquidos iónicos son muy adecuados para modificaciones usando herramientas sintéticas; por ejemplo, introduciendo grupos funcionalizados en el cation o cambiando el anion para mejorar o crear la característica deseada para una aplicación especial.
Estas propiedades inherentes y su gran adaptación convierten a los líquidos iónicos en unos candidatos excelentes para ser empleados en el campo de generación de H2 como medio de reacción y/o co-catalizador, y en el almacenamiento de energía térmica como materiales de cambio de fase.
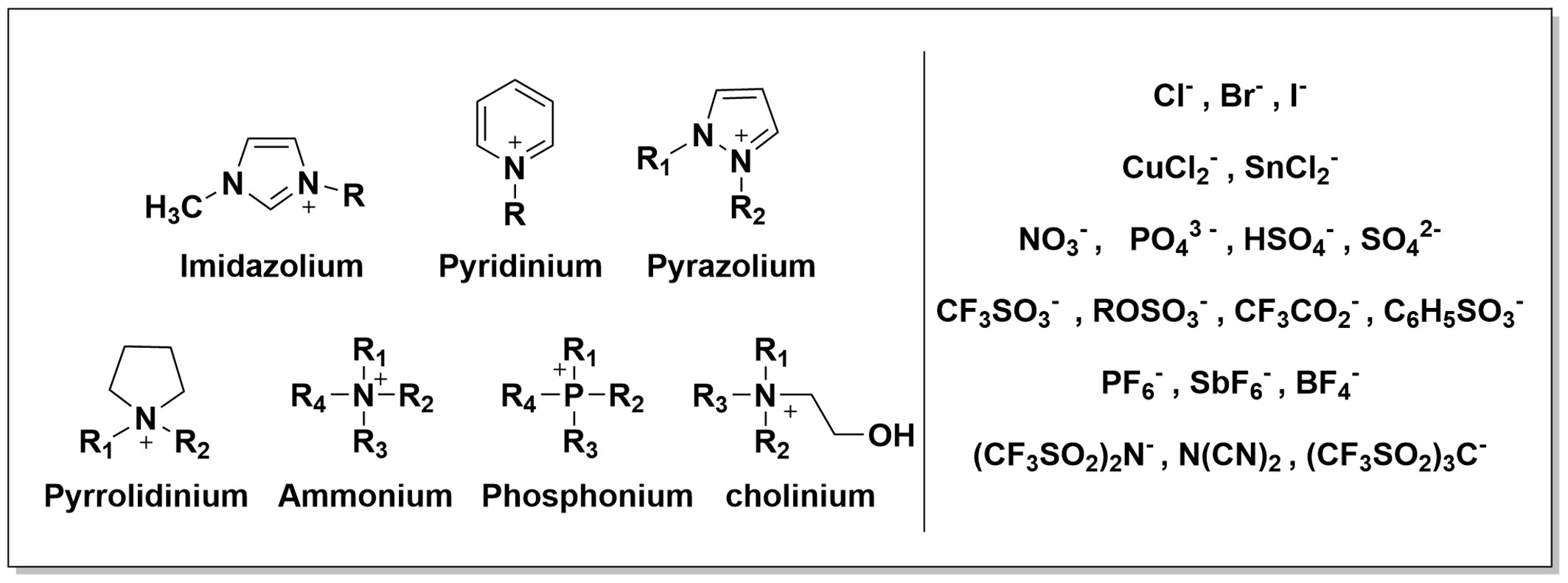
La siguiente imagen muestra algunos de los cationes y aniones más comunes usados en la síntesis de líquidos iónicos.
Los líquidos iónicos pueden dividirse en dos grandes grupos: líquido iónico aprótico y portico. Sus síntesis, empezando desde los diferentes cationes y aniones seleccionados, puede desarrollarse de diferentes maneras:
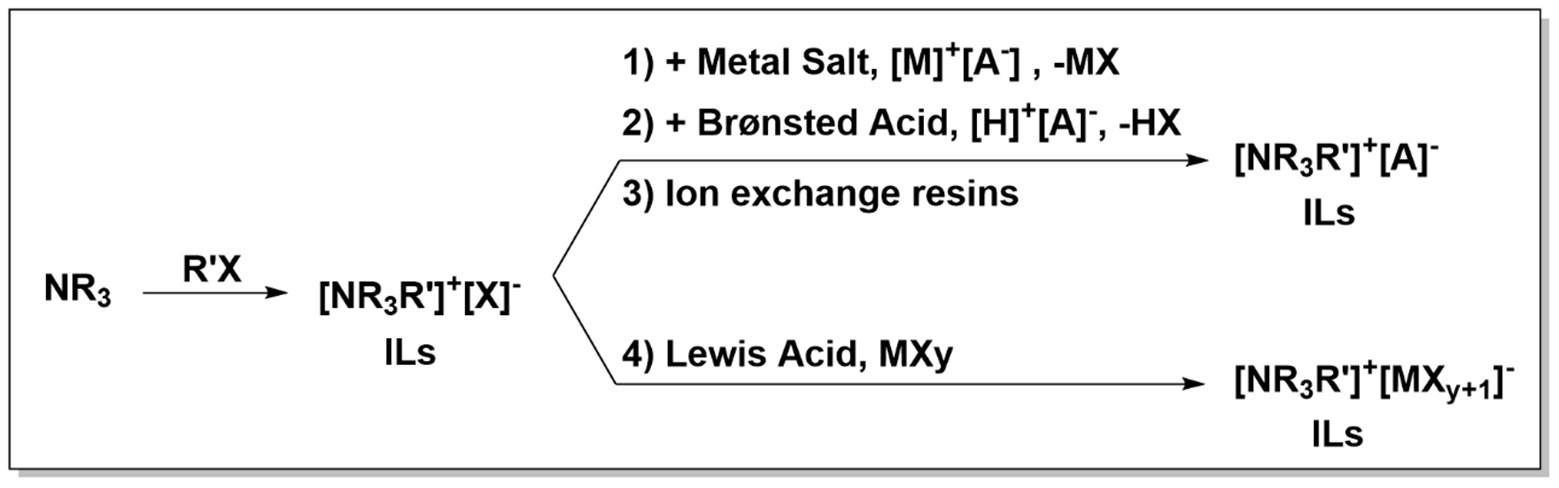
En general, la síntesis de los líquidos iónicos apróticos se inicia a partir de aminas o fosfinas (como parte catiónica) y haluros de alquilo (como parte aniónica) mediante una reacción de cuaternización seguida opcionalmente de reacciones de intercambio aniónico (por ejemplo, metátesis aniónica).
Por otro lado, la síntesis de líquidos iónicos próticos es mucho más fácil, y se obtienen por simple neutralización entre un ácido de Brønsted y una base de Brønsted. La selección del catión y del anión es clave y determinará las propiedades termofísicas de los líquidos iónicos y, consecuentemente, su ámbito de aplicación.
En la actualidad, ya se fabrican y comercializan una gran cantidad de líquidos iónicos por parte de empresas como IOLITEC (> 250 líquidos iónicos en cartera, escala de g a kg, > 1 tonelada en 2020), PROIONIC (> 1 tonelada), SCIONIX (escala de kg y 1 líquido iónico en > 1 tonelada) y SOLVIONIC (> 1,5 toneladas/mes en 2021 y > 50 toneladas/mes en 2023). Cabe destacar que todas estas empresas son muy activas y están implicadas en su propia investigación y desarrollo.
Los líquidos iónicos, debido a sus propiedades intrinsecas unicas, a las casi ilimitadas combinaciones entre cation y anion, y su relativa facilidad para modificarlos y/o funcionalizarlos, tienen una gran cantidad de aplicaciones posibles:

Como se puede apreciar, las áreas de aplicación de los líquidos iónicos abarcan desde la tecnología de procesos hasta los fluidos funcionales, pasando por la electroquímica, la analítica, el transporte y la conversión de calor, o la síntesis y la catálisis. No obstante, dado que los cationes y aniones seleccionados para formar los líquidos iónicos pueden ser casi incalculabls, sus aplicaciones potenciales crecerán en el futuro y sólo estarán limitados por la imaginación de los científicos.
Cabe pensar, erroneamente, que el principal interés en los líquidos iónicos se encuentra a nivel de investigación. Pero estos materiales únicos han acrecentado el interés de muchas compañías que han introducido los líquidos iónicos en sus procesos:
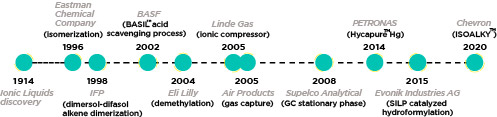
En general, estos ejemplos muestran que, debido a su versatilidad y gran cantidad de aplicaciones (las que se conocen y las que están por venir), las tecnologías basadas en líquidos iónicos pueden ser implementadas a nivel comercial e industrial. No obstante, el máximo potencial de estas tecnologías todavía está por llegar y, para explotar sus propiedades únicas a nivel comercial, el compromiso de las industrias con la investigación fundamental es de vital importancia.
En CIC energiGUNE, en el área de Soluciones de Energía Térmica (TES), diseñamos y desarrollamos nuevas tecnologías basadas en líquidos iónicos con aplicación en la producción/almacenamiento de hidrógeno y en el almacenamiento de energía térmica.
Respecto al diseño, desarrollo y caracterización de sistemas catalíticos disruptivos basados en líquidos iónicos, en CIC energiGUNE, nos propusimos obtener H2 puro y un valioso material de carbono a partir de la deconstrucción catalítica de residuos plásticos (HDPE, PP y PS) bajo métodos de calentamiento no convencionales.
Los sistemas catalíticos basados en líquidos iónicos son clave en el proceso investigado, y se proponen aumentar el rendimiento y la selectividad del proceso catalítico, preservar los centros catalíticos activos de la cocción y/o sinterización, recuperar el valioso material de carbono coproducido, recuperar y reutilizar los centros catalíticos activos y facilitar la separación del material de carbono y el H2 puro.
En cuanto al diseño, desarrollo, síntesis y caracterización de nuevos líquidos iónicos para el almacenamiento de H2, la investigación se centra en líquidos iónicos que posean estabilidad térmica y química para resistir las condiciones de hidrogenación/deshidrogenación y con suficiente densidad gravimétrica de hidrógeno (2-4 %) para ser empleados como portadores de hidrógeno líquido.
En cuanto al diseño, desarrollo, síntesis y caracterización de "cristales plásticos iónicos orgánicos (OIPCs)" (una subclase de líquidos iónicos), en CIC energiGUNE estamos desarrollando la investigación sobre OIPCs con transiciones sólido-sólido de alta energía para ser empleados como materiales de cambio de fase para almacenar calor latente para aplicaciones de baja/media temperatura (campos domésticos e industriales); y también, en el marco del proyecto ELKARTEK CICe21 y de una tesis doctoral en curso, estamos ganando en conocimiento al entender la relación entre la estructura química de los OIPCs y su rendimiento como materiales de cambio de fase.
No cabe duda de que los líquidos iónicos son materiales con propiedades extraordinarias y aplicaciones potenciales ilimitadas. A pesar de ello, sigue siendo un reto encontrar la combinación adecuada de catión/anión que pueda cumplir las características requeridas para una aplicación determinada. Por ello, en CIC energiGUNE trabajamos en nuevos enfoques para entender y desarrollar líquidos iónicos con características específicas que se apliquen en tecnologías disruptivas basadas en líquidos iónicos (descritas anteriormente) para aplicaciones más sostenibles en el campo del almacenamiento de energía térmica y la catálisis.

Autor: Eduardo José García-Suarez, investigador asociado ( Ikerbasque Research Fellow ) del grupo de investigación Transiciones de Fase y Comportamientos críticos, del área de Almacenamiento Térmico de CIC energiGUNE.

Si quieres conocer las últimas tendencias en almacenamiento de energía y novedades en investigación, suscríbete.

Si quieres unirte a un equipo de primer nivel, colaborar con especialistas en múltiples disciplinas o contarnos tus inquietudes no te lo pienses…